
Video: Hvad er bindingsvinklerne for vippe?
2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Det vippe form maksimerer bindingsvinkler af det enkelte ensomme par og de andre atomer i molekylet. Det enlige par er i en ækvatorial position med 120 og 90 grader bindingsvinkler , sammenlignet med kun 90 grader bindingsvinkler hvis den placeres i aksial position.
Hvilket molekyle har derfor en vippeform?
Oftest fire bindinger til en central atom resultere i tetraedrisk eller, mindre almindeligt, kvadratisk plan geometri. Vippegeometrien er, ligesom dens navn, usædvanlig. Det opstår, når et molekyle har et sterisk tal på 5, med det centrale atom er bundet til 4 andre atomer og 1 ensomt par (AX4E i AX notation).
Udover ovenstående, hvad er bindingsvinklerne for kvadratisk plan? Besvare bindingsvinkler i disse former ville være omtrent hvad de er i den geometriske konfiguration de kommer fra. Kvadratiske plane bindingsvinkler ville være 90 grader.
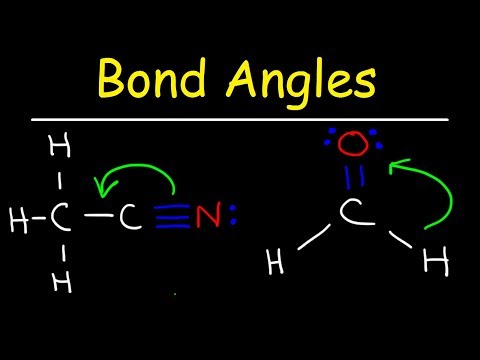
Ligeledes, hvad er bindingsvinklen for en trigonal bipyramidal?
Trigonal bipyramidal : fem atomer omkring det centrale atom; tre i et fly med bindingsvinkler på 120° og to på modsatte ender af molekylet. Octahedral: seks atomer omkring det centrale atom, alle med bindingsvinkler på 90°.
Er vippe polær eller upolær?
I VSEPR teori tvinger det enlige par SF4's molekylære geometri til en vippeform. To af S-F-bindingerne peger væk fra hinanden, og deres bindingsdipoler ophæves. Men de to andre S-F dipoler peger "nedad". Deres bindingsdipoler ophæver ikke, så molekylet er det polar.
Anbefalede:
Hvad er sociobiologi, og hvad er de største kritikpunkter af det?

Et relateret aspekt af sociobiologi omhandler altruistisk adfærd generelt. Kritikere hævdede, at denne anvendelse af sociobiologi var en form for genetisk determinisme, og at den undlod at tage højde for kompleksiteten af menneskelig adfærd og miljøets indvirkning på menneskelig udvikling
Hvad er fossiler Hvad fortæller de os om evolutionsprocessen?

Hvad fortæller de os om evolutionsprocessen? Svar: Fossiler er rester eller indtryk af organismer, der levede i en fjern fortid. Fossiler giver bevis for, at det nuværende dyr stammer fra tidligere eksisterende dyr gennem processen med kontinuerlig evolution
Hvad er Hox-gener, hvad der kan opstå, hvis et Hox-gen muterede?

På samme måde kan mutationer i Hox-generne resultere i kropsdele og lemmer på det forkerte sted langs kroppen. Ligesom en legeinstruktør optræder Hox-generne ikke i stykket eller deltager i lemmerdannelsen selv. Proteinproduktet af hvert Hox-gen er en transkriptionsfaktor
Hvad er en almindelig magnet lavet af hvad er arrangementet af elektroner?

Elektroner er arrangeret i skaller og orbitaler i et atom. Hvis de fylder orbitalerne, så der er flere spin, der peger op end ned (eller omvendt), vil hvert atom fungere som en lille magnet. Når et stykke umagnetiseret jern (eller andet ferromagnetisk materiale) udsættes for et eksternt magnetfelt, sker der to ting
Hvad er spredning af lys, hvad er dens årsag?

Opdelingen af hvidt lys i dets konstituerende farver ved at passere gennem et brydende medium som et glasprisme kaldes spredning af lys. Spredningen af hvidt lys opstår, fordi forskellige farver af lys bøjes gennem forskellige vinkler i forhold til den indfaldende stråle, når de passerer gennem et prisme
