
Video: Hvad er de fire kvantetal for elektroner, og hvordan defineres de?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Det fire kvantetal bruges til at beskrive elektroner er n=2, ℓ=1, m=1, 0 eller -1, og s=1/2 (den elektroner har parallelle spins).
Desuden, hvad beskriver de fire kvantetal om en elektron?
Til fuldstændig beskrive en elektron i et atom, fire kvantetal er nødvendige: energi (n), vinkelmomentum (ℓ), magnetisk moment (mℓ), og drej (ms). Den første kvante nummer beskriver det elektron skal, eller energiniveau, af et atom.
På samme måde, hvordan finder du kvantetallet af elektroner? Sådan bestemmes antallet af elektroner med kvantetal
- Tæl de fulde orbitaler.
- Tilføj elektronerne for hver fuld orbital.
- Identificer den underskal, der er angivet med det vinkelmæssige kvantenummer.
- Tilføj elektronerne fra de fulde underskaller.
- Tilføj elektronerne fra fulde underskaller til dem fra fulde orbitaler.
- Find de legitime værdier for det magnetiske kvantenummer.
Også for at vide, hvad er de fire kvantetal?
I atomer er der i alt fire kvantetal: det vigtigste kvantetal (n), orbitalen vinkelmoment kvantetal (l), den magnetisk kvantetal (ml), og elektronen spin kvantetal (ms).
Hvad er en Subshell?
EN subshell er en underopdeling af elektronskaller adskilt af elektronorbitaler. Subshells er mærket s, p, d og f i en elektronkonfiguration.
Anbefalede:
Hvordan defineres overfladefinish?

Overfladefinish, også kendt som overfladetekstur eller overfladetopografi, er karakteren af en overflade som defineret af de tre egenskaber lægning, overfladeruhed og bølgethed. Det omfatter de små, lokale afvigelser af en overflade fra det perfekt flade ideal (et sandt plan)
Hvordan defineres begrebet art generelt?

Hvordan defineres begrebet art generelt? En gruppe af organismer, der kan parre sig og producere frugtbart afkom af begge køn
Hvordan er elektronkonfiguration relateret til kvantetal?
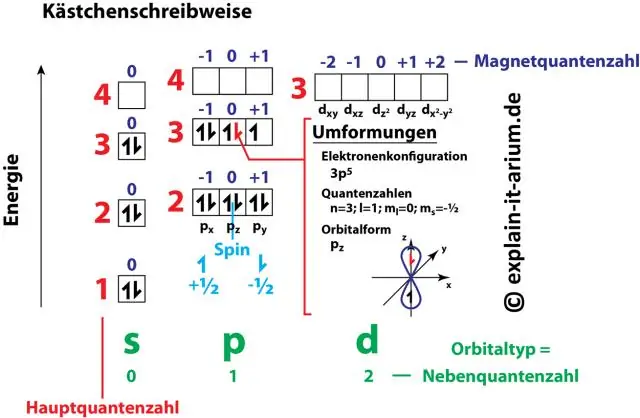
Tallet og bogstavparrene i en elektronkonfiguration repræsenterer to af elektronens fire kvantetal. Disse kvantetal fortæller os mere information om elektronernes egenskaber og deres orbitaler. Det vigtigste kvantetal (n) fortæller os en elektrons energiniveau og dens størrelse
Hvad betyder kvantetal ML?

Magnetisk kvantetal
Hvad er kvantetal i kemiklasse 11?

Kvantetal kan defineres som et sæt af 4 tal, ved hjælp af hvilke vi kan få fuldstændig information om alle elektronerne i et atom, dvs. placering, energi, typen af orbital optaget, plads og orientering af den orbital. Den fortæller det primære energiniveau eller den skal, som elektronen tilhører
