
Video: Hvad er den periodiske tendens for atomstørrelse fra top til bund i en gruppe?
2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
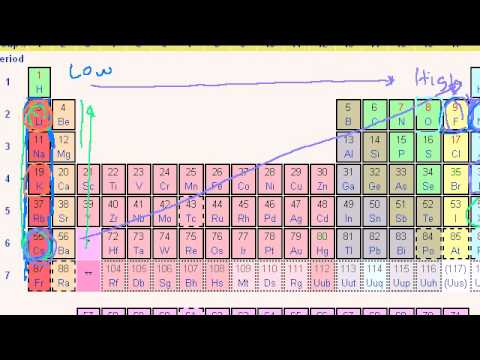
Fra top til tå ned a gruppe , falder elektronegativiteten. Dette er fordi atomar antallet stiger ned a gruppe , og dermed er der en øget afstand mellem valenselektronerne og kernen, eller en større atomradius.
I betragtning af dette, hvorfor øges atomstørrelsen ned ad en gruppe?
Generelt, atomradius falder over en periode og stiger ned ad en gruppe . Ned en gruppe , antallet af energiniveauer (n) stiger , så der er en større afstand mellem kernen og den yderste orbital. Dette resulterer i en større atomradius.
Også, hvad er tendensen i 1. ioniseringsenergi fra top til bund og ned i en gruppe? Flytning fra venstre mod højre over en periode, atomradius falder, så elektroner tiltrækkes mere af den (tættere) kerne. Den generelle tendens er, at ioniseringsenergi falder ved at bevæge sig fra top til bund ned i en gruppe af periodisk tabel. Bevæger man sig ned ad en gruppe, tilføjes en valensskal.
Ved også, hvad er den periodiske tendens i variationen af Valency, mens du går ned i en gruppe?
» Alle medlemmer af en gruppe har det samme antal valenselektroner. » Atomradius stiger normalt mens du går ned i en gruppe på grund af tilføjelsen af et nyt energiniveau (skal).
Hvilken tendens i atomradius ser du, når du går ned i en gruppefamilie på det periodiske system?
En stærkere kernepakke trækker elektroner tættere på, pakker dem tættere sammen og i sidste ende reducerer atomradius . Som du går ned -en familie på det periodiske system , falder ioniseringsenergien. Antallet af energiniveauer stiger som du går ned det periodiske system.
Anbefalede:
Hvad er definitionen af en gruppe i det periodiske system?

I kemi er en gruppe (også kendt som en familie) en søjle af grundstoffer i det periodiske system af de kemiske grundstoffer. Der er 18 nummererede grupper i det periodiske system; f-blok kolonnerne (mellem gruppe 3 og 4) er ikke nummereret
Hvad er den korrekte rækkefølge af jordens atmosfæriske lag fra bund til top?

Hvad er den korrekte rækkefølge af jordens atmosfæriske lag fra bund til top? Stratosfæren, Mesosfæren, Troposfæren, Termosfæren, Exosfæren
Hvad hedder gruppe 18 i det periodiske system?

Gruppe 18: Ædelgasserne. Ædelgasserne (Gruppe 18) er placeret yderst til højre i det periodiske system og blev tidligere omtalt som 'inerte gasser' på grund af det faktum, at deres fyldte valensskaller (oktetter) gør dem ekstremt ikke-reaktive
Hvad er den seneste tilføjelse til det periodiske system af grundstoffer?

Det periodiske system får fire nye officielle tilføjelser. Nihonium, Moscovium, Tennessine og Oganesson er officielt officielt. I denne uge tilføjede International Union of Pure and Applied Chemistry numrene 113, 115, 117 og 118 til Periodetabellen over grundstoffer (114 og 116 – Livermorium og Flerovium – blev tilføjet i 2012)
Hvad er den korrekte rækkefølge af atmosfæriske lag fra bund til top?

Hvad er den korrekte rækkefølge af jordens atmosfæriske lag fra bund til top? Stratosfæren, Mesosfæren, Troposfæren, Termosfæren, Exosfæren
