Indholdsfortegnelse:

Video: Hvordan beregner man solvationsvarme?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2024-01-18 08:14
Opløsningsvarme eller opløsningens entalpikemi vejledning
- Mængden af frigivet eller absorberet energi beregnes. q = m × Cg × ΔT. q = mængden af frigivet eller absorberet energi.
- Beregn mol opløst stof. n = m ÷ M. n = mol opløst stof.
- Mængde energi ( varme ) frigivet eller absorberet pr. mol opløst stof beregnes. ΔHsoln = q ÷ n.
Simpelthen, hvordan beregner du opløsningsvarmen i kJ mol?
Entalpi af opløsning (opløsningsvarme) Eksempel
- Beregn den frigivne varme, q, i joule (J), ved reaktionen: q = masse (vand) × specifik varmekapacitet (vand) × ændring i temperatur (opløsning)
- Beregn mol opløst stof (NaOH(s)): mol = masse ÷ molær masse.
- Beregn entalpiændringen, ΔH, i kJ mol-1 af opløst stof:
hvad er opløsningsvarmen af NaOH? Den accepterede værdi for varme af opløsning af NaOH er 44,2 kJ/mol og for NH4NO3 er den 25,4 kJ/mol.
Efterfølgende kan man også spørge, hvordan man beregner varmeoptaget?
Det varme absorberes er beregnet ved at gange molerne vand med molaren varme af fordampning. 5. Damp opvarmes fra 100oC til 140oC. Det varme absorberes er beregnet ved at bruge det specifikke varme af damp og ligning ΔH=cp×m×ΔT.
Hvad er den specifikke varme af NaOH?
Minimumstemperatur som starttemperatur=43,5°C. Densitet af HCl & NaOH Opløsning = 1,04 g/ml. Specifik varme af HCl & NaOH Opløsning = 4,017 J/g°C.
Anbefalede:
Hvordan beregner man standardafvigelsen fra PMP?

Formlen brugt i PMBOK for standardafvigelse er enkel. Det er bare (P-O)/6. Det er det pessimistiske aktivitetsestimat minus det optimistiske aktivitetsestimat divideret med seks. Problemet er, at denne form eller form på ingen måde giver et mål for standardafvigelse
Hvordan beregner man Jordens omkreds på dens breddegrad?

Omkredsen af en cirkel er lig med 2πr hvor r er dens radius. På Jorden er kuglens omkreds på en given breddegrad 2πr(cos θ), hvor θ er breddegraden og r er jordens radius ved ækvator
Hvordan beregner man frekvens ud fra frekvens og procent?
For at gøre dette skal du dividere frekvensen med det samlede antal resultater og gange med 100. I dette tilfælde er frekvensen af den første række 1, og det samlede antal resultater er 10. Procentdelen ville så være 10,0. Den sidste kolonne er kumulativ procentdel
Hvordan beregner man potentielt fald i et kredsløb?
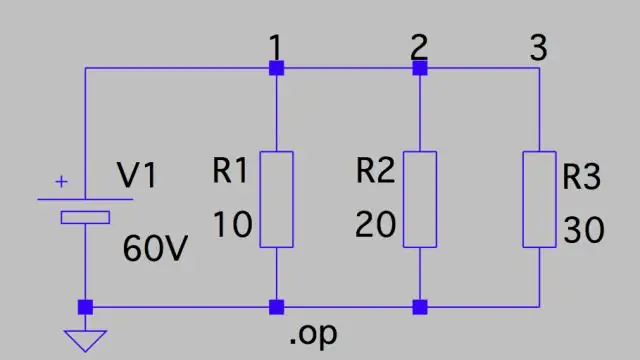
Spændingsfald: Parallel kredsløb Dette betyder, at spændingsfaldet over hver af dem kun er kredsløbets samlede spænding divideret med antallet af modstande i kredsløbet, eller 24 V/3 = 8 V
Hvordan beregner man den procentvise mængde af klor?

Klorisotopen med 18 neutroner har en overflod på 0,7577 og et massetal på 35 amu. For at beregne den gennemsnitlige atommasse skal du gange brøken med massetallet for hver isotop og derefter lægge dem sammen
