
Video: Hvad er kollisionsteorien for kemiske reaktioner?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Kollisionsteori , teori bruges til at forudsige satserne for kemiske reaktioner , især for gasser. Det kollisionsteori er baseret på den antagelse, at for en reaktion for at opstå er det nødvendigt at de reagerende arter (atomer eller molekyler) kommer sammen eller kollidere med hinanden.
Desuden, hvad er de 3 dele af kollisionsteori?
Der er tre vigtig dele til kollisionsteori , at reagerende stoffer skal kollidere , at de skal kollidere med nok energi, og det skal de kollidere med den rigtige orientering.
Man kan også spørge, hvordan laver man kollisionsteori? Når en katalysator er involveret i kollision mellem reaktantmolekylerne kræves der mindre energi til den kemiske ændring til tage sted, og dermed mere kollisioner har tilstrækkelig energi til at reaktionen kan finde sted. Reaktionshastigheden stiger derfor. Kollisionsteori er tæt forbundet med kemisk kinetik.
hvordan forklarer kollisionsteorien hastigheden af kemisk reaktion?
Det kollisionsteori siger det kemisk reaktion kun forekomme, hvis der er kollisioner af de rigtige energiniveauer mellem molekyler og atomer. Det følger, at hvis molekylerne kollidere oftere, at dette vil øge sats af reaktion . Jo højere temperatur, jo mere kinetisk energi har molekyler og atomer.
Hvad er en vellykket kollision i kemi?
Molekyler skal kollidere med tilstrækkelig energi, kendt som aktiveringsenergien, således at kemisk bindinger kan brydes. Molekyler skal kollidere med den rette orientering. EN kollision der opfylder disse to kriterier, og som resulterer i en kemisk reaktion, er kendt som en vellykket kollision eller en effektiv kollision.
Anbefalede:
Hvad ville der ske, hvis der ikke var nogen kemiske reaktioner?

Uden kemiske reaktioner ville intet nogensinde ændre sig. Atomer ville forblive atomer. Nye molekyler ville ikke dannes. Ingen organismer kunne leve
Hvad er sandt om kemiske reaktioner?

I en kemisk reaktion er det kun de atomer, der er til stede i reaktanterne, der kan ende i produkterne. Ingen nye atomer skabes, og ingen atomer ødelægges. I en kemisk reaktion kommer reaktanter i kontakt med hinanden, bindinger mellem atomer i reaktanterne brydes, og atomer omarrangeres og danner nye bindinger for at lave produkterne
Hvad er forskellene mellem fysiske og kemiske reaktioner i kemi?

Forskellen mellem en fysisk reaktion og en kemisk reaktion er sammensætningen. Ved en kemisk reaktion sker der en ændring i sammensætningen af de pågældende stoffer; i en fysisk ændring er der en forskel i udseendet, lugten eller simpel visning af en prøve af stof uden ændring i sammensætningen
Hvad er kemiske symboler og kemiske formler?
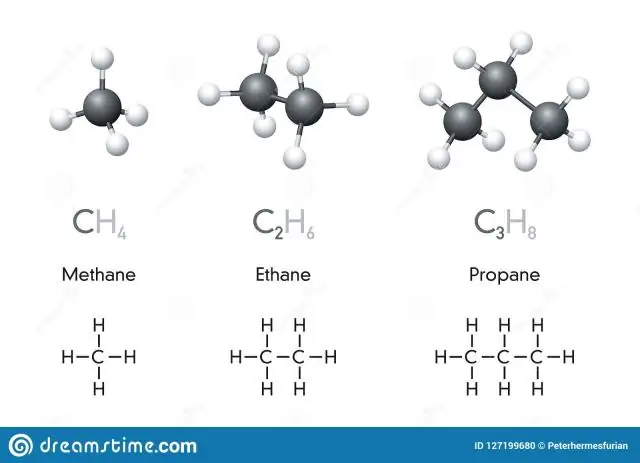
Et kemisk symbol er en betegnelse på et eller to bogstaver af et grundstof. Forbindelser er kombinationer af to eller flere elementer. En kemisk formel er et udtryk, der viser grundstofferne i en forbindelse og de relative proportioner af disse grundstoffer. Mange elementer har symboler, der stammer fra det latinske navn for elementet
Hvad er en vigtig forskel mellem kemiske og nukleare reaktioner Brainly?

(1) Nukleare reaktioner involverer en ændring i et atoms kerne, som normalt producerer et andet grundstof, sammen med udsendelsen af stråling som α,βogγ osv stråler. Kemiske reaktioner involverer på den anden side kun en omlejring af elektroner og involverer ikke ændringer i kernerne
