
Video: Hvorfor er den anden ioniseringsenergi af lithium så usædvanligt større end den første?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Sekund Ionisering Energier er altid højere end den første på grund af to hovedårsager: Du fjerner elektronen fra en position, hvor den er lidt tættere på kernen, og derfor er underlagt større tiltrækning til kernen.
Desuden, hvorfor er den anden ioniseringsenergi af et grundstof altid større end den første?
Det anden ioniseringsenergi af Mg er større end den første fordi det altid tager mere energi at fjerne en elektron fra en positivt ladet ion end fra en neutral atom.
hvorfor er den første ioniseringsenergi af beryllium større end lithium? Beryllium (Gruppe II) har en ekstra elektron og proton i forhold til lithium . Den ekstra elektron går ind i den samme 2s orbital. Stigningen i ioniseringsenergi (I. E.) Tilsvarende er I. E. ilt er mindre end det af nitrogen, fordi den ekstra elektron er afskærmet af den halvt fyldte 2p orbital.
For det andet, hvorfor har Li en større anden ioniseringsenergi end være?
Dette er på grund af stigningen i nuklear ladning på grund af tilføjelse af elektroner. Nu danner den Be+ som er ustabil, så til få stabil (Be++) den sekund elektron skal fjernes, så vi brug for mindre energi at fjerne den elektron og derfor er det anden ionisering er mere det Li.
Er den første ioniseringsenergi større end den anden?
Det energi at fjerne en elektron fra et neutralt atom kaldes første ioniseringsenergi , og energi nødvendigt at fjerne sekund elektron kaldes anden ioniseringsenergi . Det anden ioniseringsenergi er generelt, bedre end det første ioniseringsenergi.
Anbefalede:
Hvilken sten er større end brosten?

Sedimentære bjergarter kan bestå af brosten. Brosten er sten, der er større end småsten, men mindre end kampesten. Konglomerat og breccia er
Hvad er større end en galakse, men mindre end et univers?

Mælkevejen er stor, men nogle galakser, som vores Andromedagalakse-nabo, er meget større. Universet er alle galakserne - milliarder af dem! Vores sol er én stjerne blandt milliarderne i Mælkevejsgalaksen. Vores Mælkevejsgalakse er en blandt de milliarder af galakser i vores univers
Er sin i anden omgang x lig med sin x i anden?
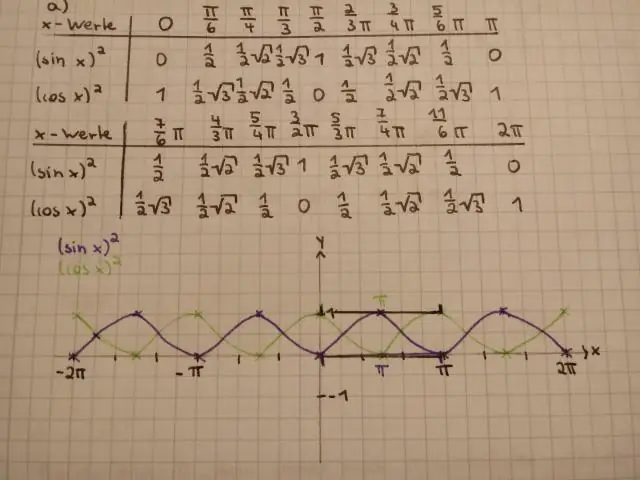
Ja det er. sin^2x er den samme assinx^2, fordi '^2' i begge tilfælde kun vedrører x
Hvorfor er dyreceller større end planteceller?

Normalt er planteceller større i forhold til dyreceller, fordi de fleste modne planteceller indeholder en stor central vakuole, som optager størstedelen af volumen og gør cellen større, men central vakuole er normalt fraværende i dyreceller. Hvordan adskiller en dyrecelle cellevægge sig fra en plantecelle?
Hvorfor er det usædvanligt, at grafit leder elektricitet?

Grafit, der er et kulmineral/malm, udviser naturligt elektrisk ledningsevne. Det kan lede elektricitet på grund af den store mængde frie ubundne elektroner, der flyder inden for dets kulstoflag. Disse valenselektroner kan bevæge sig frit, så de er i stand til at lede elektricitet
