
Video: Hvad er den formelle ladning af nitrogen i denne struktur?
2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Fortsætter med nitrogen , bemærker vi, at i (a) den nitrogen atom deler tre bindingspar og har et ensomt par og har i alt 5 valenselektroner. Det formel afgift på den nitrogen atom er derfor 5 - (2 + 6/2) = 0. I (b) er den nitrogen atom har en formel afgift af -1.
Også, hvad er den formelle ladning af nitrogen?
Valenselektronerne af nitrogen i dets forbindelser er alle sp³ hybridiserede orbitaler. Det formel afgift på N er sædvanligvis -1 for en anion, 0 for en neutral forbindelse og +1 i kationer. EN nitrogen atom med en formel afgift på -3 ville svare til en nitridion, N³?, som er stærkt basisk i vandig opløsning.
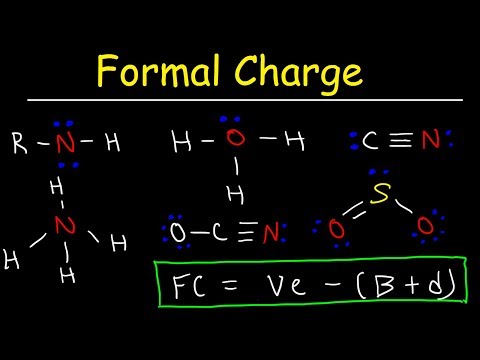
På samme måde, hvordan beregner du formel afgift? Formel sigtelse = [# valenselektroner på neutralt atom] – [(# enlige elektronpar) + (½ # bindingselektroner)] Valenselektroner = svarer til gruppenummeret i det periodiske system (for repræsentative grundstoffer). Lone Pairs = enlige elektroner, der sidder på atomet. Hver elektron tæller som et og så et par tæller som to.
Også at vide er, hvad er den formelle ladning af nitrogen i det viste billede?
Klik på enten billede for at se den optimerede geometri. Det nitrogen atom har fire bindinger med hydrogen, hvilket giver nitrogen atom i alt 4 valenselektroner. Atomar nitrogen har 5 valenselektroner, og så (5-4) = +1 og det er korrekt mærket som en formel afgift af +1.
Er ilt positiv eller negativ?
Et godt eksempel er et iltatom, der deler en elektron med hver af to i nærheden hydrogenatomer , hvilket laver et molekyle af vand H2O. Et oxygenatom, der med succes har doneret en eller to elektroner eller deler en eller to elektroner, har mistet en del af sin negative ladning, så det efterlades positivt ladet.
Anbefalede:
Hvad er relativ masse og ladning?

Den relative masse af en proton er 1, og en partikel med en relativ masse mindre end 1 har mindre masse. Da en kerne indeholder protoner og neutroner, er det meste af massen af et atom koncentreret i dets kerne. Protoner og elektroner har modsatte elektriske ladninger
Hvad står S for, og hvad sker der i denne fase?

S-stadiet står for 'Synthesis'. Dette er stadiet, hvor DNA-replikation finder sted. G2-scenen står for 'GAP 2'
Hvad hedder en tinion, der har en ladning på 4+?

Liste over kationer Indeksnavn Symbol 81 tin(IV) Sn4+ 82 bly(II) Pb2+ 83 bly(IV) Pb4+ 84 ammonium NH4+
Hvad er en mulig ladning af en anion?

Ioner stammer fra atomer eller molekyler, der har fået eller mistet en eller flere valenselektroner, hvilket giver dem en positiv eller negativ ladning. Dem med en negativ ladning kaldes anioner og dem med en positiv ladning kaldes kationer
Er elektrisk ladning en egenskab ved blot elektricitet eller er ladning en egenskab ved alle atomer?

En positiv ladning tiltrækker en negativ ladning og frastøder andre positive ladninger. Er elektrisk ladning en egenskab ved blot elektricitet eller er ladning en egenskab ved alle atomer? Elektrisk ladning er en egenskab for alle atomer
