
Video: Hvorfor er entalpien for dannelse af elementer nul?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Det dannelsesentalpi til en element i sin elementære tilstand vil altid være 0 fordi det ikke kræver energi at danne en naturligt forekommende forbindelse. Når et stof er dannet fra dens mest stabile form elementer , en ændring i entalpi finder sted.
På samme måde kan man spørge, hvilke stoffer har en dannelsesentalpi på nul?
Alle grundstoffer i deres standardtilstande (iltgas, fast kulstof i form af grafit osv.) har en standard dannelsesentalpi på nul, da der ikke er nogen ændring involveret i deres dannelse.
Efterfølgende er spørgsmålet, hvad er entalpien for dannelse af vand? Valgt ATcT-dannelsesentalpi baseret på version 1.118 af Thermochemical Network
| Artens navn | Formel | ΔfH°(298,15 K) |
|---|---|---|
| Vand | H2O (cr, eq.press.) | -292.740 |
Tilsvarende, hvorfor er standardentalpien for dannelse af diamant ikke nul, selvom den er et element?
Det standard dannelsesentalpi til en element i dets standard tilstand er NUL !!!! Så ΔH°f for C (s, grafit) er nul , men ΔH°f for C (s, diamant ) er 2 kJ/mol. Det er fordi grafit er standard tilstand for kulstof, ikke diamant.
Hvad betyder det, når Delta h er nul?
De kan kun måle ændringer i entalpi. Når entalpi er positiv og delta H er større end nul , det her midler at et system optog varme. Dette kaldes en endoterm reaktion. Når entalpi er negativ og delta H er mindre end nul , det her midler at et system afgiver varme. Dette kaldes en eksoterm reaktion.
Anbefalede:
Hvorfor er induceret emf nul, når den magnetiske flux er maksimal?

Når spolen er oprejst, er der ingen ændring i magnetisk flux (dvs. emf=0), fordi spolen ikke "skærer over" feltlinjerne. Den inducerede emk er nul, når spolerne er vinkelrette på feltlinjerne og maksimal, når de er parallelle. Husk, den inducerede emk er ændringshastigheden i magnetisk fluxbinding
Hvad er entalpien for calciumchlorid?

Den målte værdi for entalpien af opløsning for vandfrit calciumchlorid (den værdi, som vi forsøger at beregne her) er omkring -80 kJ mol-1
Hvorfor er EMF nul, når spolen passerer gennem magnetens nøjagtige centrum?
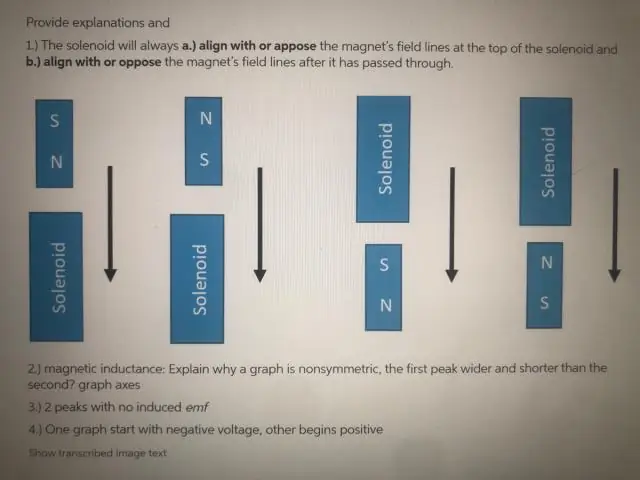
Emf er kun nul i et øjeblik, da magneten passerer gennem det nøjagtige centrum af spolen. Dette skyldes, at effekten af N-polen i den ene ende af magneten på den ende af spolen, nøjagtigt udlignes af effekten af magnetens S-pol på den anden ende af spolen
Hvad er entalpien for dannelse af Cao?

Tabel over dannelsesvarme Forbindelse ΔHf (kJ/mol) CaCO3 -1207,0 CaO(s) -635,5 Ca(OH)2(s) -986,6 CaSO4(s) -1432,7
Hvad er absolut nul, og hvorfor kaldes det sådan?

Absolut nul er -273,15 grader Celsius, -459,67 grader Fahrenheit og 0 Kelvin. Såkaldt fordi det er det punkt, hvor naturens fundamentale partikler har minimal vibrationsbevægelse, idet de kun bevarer kvantemekanisk, nulpunkts energi-induceret partikelbevægelse
