
Video: Hvordan finder man ændringen i en gass indre energi?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Ændring i en gass indre energi ved konstant volumen. Ifølge termodynamikkens første lov er u=q+w, hvor u er ændring i indre energi , q er varmefrigivet, og w er det arbejde, der udføres i processen. Nu ved konstant volumen, w=0, derfor u=q.
Heri, hvad er den indre energi af en gas?
En gass indre energi er summen af al kinetik energi (Translationel, Rotationel og Vibrationel) - for alle molekyler i gas . Det afhænger af temperaturen på Gas.
hvad er indre energi egentlig? Intern energi er defineret som energi forbundet med den tilfældige, uordnede bevægelse af molekyler. Den er adskilt i skala fra den makroskopiske ordnede energi forbundet med bevægelige genstande; det refererer til det usynlige mikroskopiske energi på atomær og molekylær skala.
Udover ovenstående, hvad er formlen for indre energi?
Da systemet har konstant volumen (ΔV=0), er udtrykket -PΔV=0 og arbejde lig med nul. Således i ligning ΔU=q+w w=0 og ΔU=q. Det indre energi er lig med systemets varme. Den omgivende varme stiger, så varmen i systemet falder, fordi varme ikke skabes eller ødelægges.
Hvad er ændring i indre energi?
Det ændring i indre energi kan være positiv eller negativ (det samme kan varmen og arbejdet). Det lave om er defineret som finalen indre energi minus initialen indre energi . ΔU=Uf−Ui. Altså negativt lave om betyder finalen energi er lavere end initialen energi.
Anbefalede:
Hvordan finder man dimensionerne, når man får areal og omkreds?
Find længde og bredde, når du kender areal og omkreds Hvis du tilfældigvis kender afstanden omkring rektanglet, som er dets omkreds, kan du løse et par ligninger for L og W. Den første ligning er, at for areal, A = L ⋅ W, og den anden er, at for perimeter, P = 2L + 2W
Hvordan transporteres energi udad i solens indre quizlet?

Energi bevæger sig gennem de dybeste lag af Solen - kernen og strålingszonen - i form af tilfældigt hoppende fotoner. Efter at energi kommer ud fra strålingszonen, fører konvektion den resten af vejen til fotosfæren, hvor den udstråles ud i rummet som sollys
Hvordan finder man højden af en kasse, når man får overfladearealet?
Find ud af ting om en kasse En kasse er oftest kendetegnet ved dens højde og bredde, W og dens længde L. Bredden, højden og længden af en kasse kan alle være forskellige. Rumfanget eller mængden af plads inde i en kasse er h × B × L. Det udvendige overfladeareal af en kasse er 2(h × B) + 2(h × L) + 2(B × L)
Hvad forårsager ændringen i cellens form?

Tre generelle faktorer bestemmer celleformen: tilstanden af cytoskelettet, mængden af vand, der pumpes ind i en celle, og tilstanden af cellevæggen. Hver af disse tre faktorer er meget dynamiske, hvilket betyder, at de konstant er i forandring eller pludselig kan ændres. Denne dynamik er, hvordan celler kan variere i form
Hvordan finder du det indre af en vinkel?

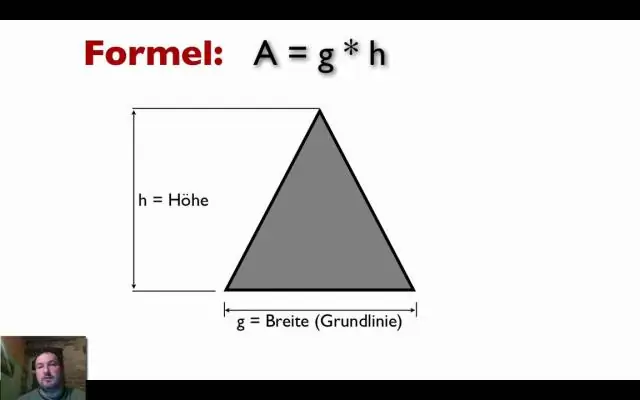
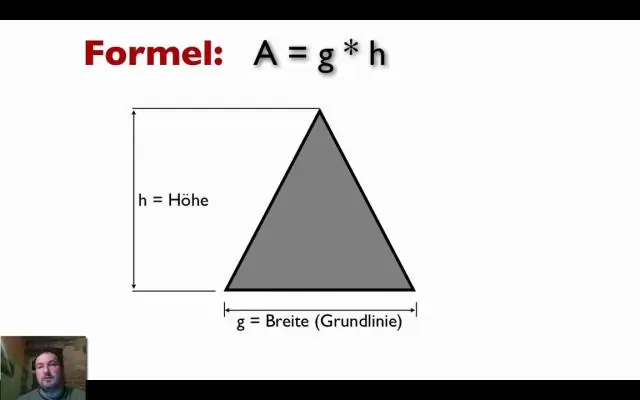
Sådan finder du indvendige vinkler Summen af vinklerne i en trekant er altid lig med 180o. Kvadrater har 4 lige store sider, og summen af vinklerne er altid lig med 360o. For at finde målingen af de indre vinkler i en firkant dividerer du summen af vinklerne (360o) med antallet af sider (4)
