
Video: Hvordan finder man frekvensfaktoren i aktiveringsenergi?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Det Arrhenius ligning er k = Ae^(-Ea/RT), hvor A er frekvens eller før- eksponentiel faktor ande^(-Ea/RT) er den brøkdel af kollisioner, der har nok energi at reagere (dvs. have energi større end eller lig med aktiveringsenergi Ea) ved temperatur T.
Bare så, hvad er frekvensfaktoren for en reaktion?
Temperatur afhængighed af Reaktioner I en første rækkefølge reaktion , enhederne af den præ-eksponentielle faktor er gensidige sekunder. Den præ-eksponentielle faktor , A, er en konstant, der kan udledes eksperimentelt eller numerisk. Det kaldes også frekvensfaktor , og beskriver antallet af gange to molekyler kolliderer.
hvad er frekvensfaktoren i kemi? Det frekvensfaktor bruges til at beskrive hastigheden af molekylære kollisioner, der forekommer i kemisk reaktion. Den frekvensfaktor opnås generelt eksperimentelt for at sikre, at mængderne af en kemisk reaktion (temperatur, aktiveringsenergi og hastighedskonstant) passer til Arrhenius-ligningens form.
Efterfølgende kan man også spørge, hvordan man beregner aktiveringsenergi?
Værdien af hældningen (m) er lig med -Ea/R, hvor R er en konstant lig med 8,314 J/mol-K. Det aktiveringsenergi kan også findes algebraisk ved at erstatte to hastighedskonstanter (k1, k2) og de to tilsvarende reaktionstemperaturer (T1, T2) ind i Arrhenius Ligning (2).
Hvordan regner man en præeksponentiel faktor ud?
- k er hastighedskonstanten i enheder af 1M1−m−n⋅s, hvor m og n er rækkefølgen af henholdsvis reaktant A og B i reaktionen.
- A er den præ-eksponentielle faktor, der korrelerer med antallet af korrekt orienterede kollisioner.
Anbefalede:
Hvordan finder man molekylvægten af NaOH?

Svar og forklaring: Den molære masse af natriumhydroxid er lig med 39,997 g/mol. For at bestemme molmassen skal du gange atommassen med antallet af atomer i formlen
Hvordan finder man gennemsnitshastigheden med to hastigheder?
Summen af start- og sluthastigheden divideres med 2 for at finde gennemsnittet. Gennemsnitshastighedsberegneren bruger formlen, der viser, at gennemsnitshastigheden (v) er lig med summen af sluthastigheden (v) og begyndelseshastigheden (u), divideret med 2
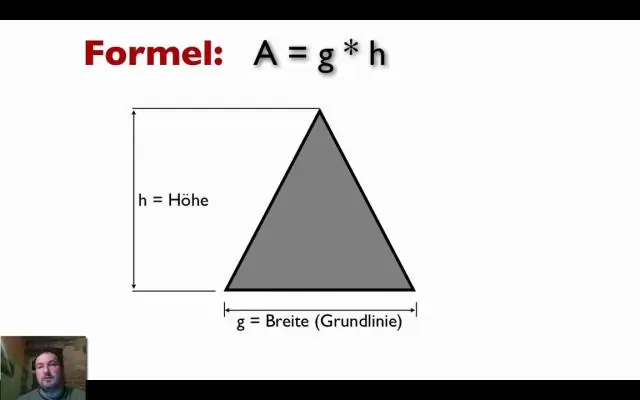
Hvordan finder man dimensionerne, når man får areal og omkreds?
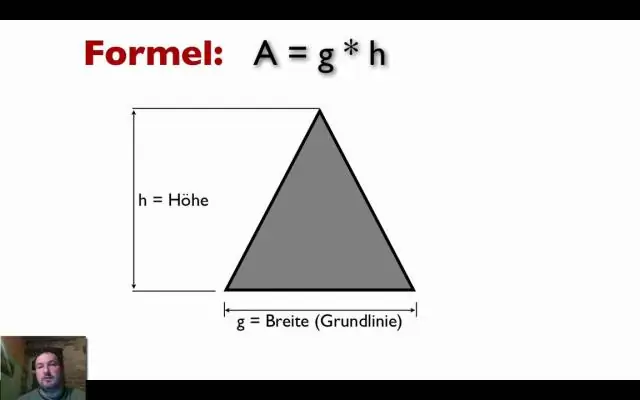
Find længde og bredde, når du kender areal og omkreds Hvis du tilfældigvis kender afstanden omkring rektanglet, som er dets omkreds, kan du løse et par ligninger for L og W. Den første ligning er, at for areal, A = L ⋅ W, og den anden er, at for perimeter, P = 2L + 2W
Hvordan finder man højden af en kasse, når man får overfladearealet?
Find ud af ting om en kasse En kasse er oftest kendetegnet ved dens højde og bredde, W og dens længde L. Bredden, højden og længden af en kasse kan alle være forskellige. Rumfanget eller mængden af plads inde i en kasse er h × B × L. Det udvendige overfladeareal af en kasse er 2(h × B) + 2(h × L) + 2(B × L)
Hvordan finder man længden af et rektangel, når man får omkredsen?

Find længde og bredde, når du kender areal og perimeter Hvis du tilfældigvis kender afstanden omkring dit rektangel, som er dets omkreds, kan du løse et par ligninger for L og W. Den første ligning er, at for areal, A = L ⋅ W, og den anden er, at for perimeter, P = 2L+ 2W
