
Video: Hvad er vandmolekyler?
2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Det vandmolekyle er meget enkel. EN molekyle er et stykke stof, der indeholder to eller flere atomer. Det kaldes H2O, fordi det har to hydrogenatomer (H) og et oxygenatom (O). Der er millioner af disse molekyler i en dråbe vand . Formen vand tager afhænger af bevægelsen af vandmolekyler.
Hvad er definitionen af et vandmolekyle heraf?
Det vandmolekyle er meget enkel. EN molekyle er et stykke stof, der indeholder to eller flere atomer. Det kaldes H2O, fordi det har to hydrogenatomer (H) og et oxygenatom (O). Der er millioner af disse molekyler i en dråbe vand.
Desuden, hvordan fungerer vandmolekyler? Vand . Vandmolekyler er naturligt tiltrukket og klæber til hinanden på grund af denne polaritet og danner en brintbinding. Denne brintbinding er årsagen til mange af vands særlige egenskaber, såsom det faktum, at den er tættere i sin flydende tilstand end i sin faste tilstand (is flyder på vand ).
Simpelthen så, hvilke molekyler udgør vand?
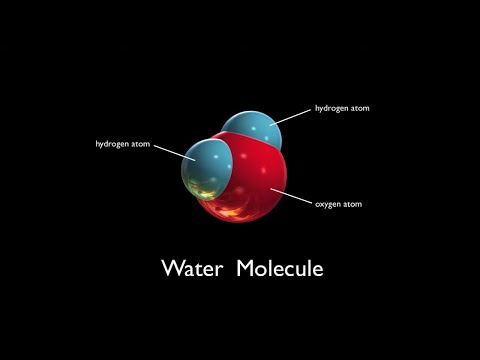
Et vandmolekyle består af tre atomer; en ilt atom og to brint atomer, der bindes sammen som små magneter. Atomerne består af stof, der har en kerne i midten.
Er vand et molekyle?
Forbindelser indeholder to eller flere forskellige grundstoffer. Vand er en molekyle fordi den indeholder molekylær obligationer. Vand er også en forbindelse, fordi den er lavet af mere end én slags grundstof (ilt og brint). Denne type molekyle kaldes en diatomisk molekyle , a molekyle lavet af to atomer af samme type.
Anbefalede:
Hvilke intermolekylære kræfter vil påvirke vekselvirkningen mellem vandmolekyler?

1 svar. Faktisk har vand alle tre typer intermolekylære kræfter, hvor den stærkeste er hydrogenbinding. Alle ting har London-spredningskræfter, de svageste vekselvirkninger er midlertidige dipoler, der dannes ved forskydning af elektroner i et molekyle
Hvorfor hænger vandmolekyler sammen?

Molekyler af rene stoffer tiltrækkes af sig selv. Denne sammenklæbning af ens stoffer kaldes kohæsion. Afhængigt af hvor tiltrukket molekyler af det samme stof er til hinanden, vil stoffet være mere eller mindre sammenhængende. Hydrogenbindinger får vand til at blive ekstraordinært tiltrukket af hinanden
Hvordan kan hydrogenbinding mellem vandmolekyler hjælpe med at forklare vands evne til at absorbere store mængder energi før fordampning?

Hydrogenbindingerne i vand gør det muligt at absorbere og frigive varmeenergi langsommere end mange andre stoffer. Temperatur er et mål for molekylers bevægelse (kinetisk energi). Efterhånden som bevægelsen øges, er energien højere og dermed temperaturen højere
Hvor hurtigt bevæger vandmolekyler sig?

Jo hurtigere et molekyle bevæger sig, jo mere kinetisk energi har det, og jo højere er den målte temperatur. Når vandet har stuetemperatur (20 °C eller 68 °F), er den gennemsnitlige hastighed for vandmolekylerne i vandet cirka 590 m/s (≈1300 mph). Men dette er kun den gennemsnitlige (eller middel) hastighed af vandmolekylerne
Er vandmolekyler tiltrukket af andre polære molekyler?

Som et resultat af vands polaritet tiltrækker hvert vandmolekyle andre vandmolekyler på grund af de modsatte ladninger mellem dem og danner brintbindinger. Vand tiltrækker eller tiltrækkes også af andre polære molekyler og ioner, herunder mange biomolekyler, såsom sukkerarter, nukleinsyrer og nogle aminosyrer
