Video: Hvordan beregner man strontiums gennemsnitlige atommasse?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Så vi Beregn det ved at tage det vægtede masse af hver af isotoperne og lægge dem sammen. Så for det første masse , vil vi gange 0,50 % af 84 (amu - atommasse enheder) = 0,042 amu, og tilføj det til 9,9% af 86 amu = 8,51 amu, og så videre.
Efterfølgende kan man også spørge, hvordan man beregner den gennemsnitlige atommasse?
Beregning af gennemsnitlig atommasse Det gennemsnitlig atommasse af et element er summen af masser af dens isotoper, hver ganget med dens naturlige overflod (decimalen forbundet med procent af atomer af det element, der er af en given isotop). Gennemsnitlig atommasse = f1M1 + f2M2 +…
Ved også, hvilke tre typer information er nødvendige for at beregne en gennemsnitlig atommasse? Antallet af isotoper, der eksisterer for grundstoffet. Det Atomar Nummer for elementet. Den procentvise overflod af hver isotop.
Man kan også spørge, hvilken værdi er tættest på atommassen af strontium?
Strontium . I sin rapport fra 1961 anbefalede Kommissionen Ar(Sr) = 87,62 baseret på masse -spektrometrisk bestemmelse af Nier. Det her værdi blev revideret til Ar(Sr) = 87,62(1) i 1969, og den forbliver uændret siden.
Hvad har en masse på 1 amu?
En atommasseenhed (symboliseret AMU eller amu) er defineret som præcis 1/12 massen af et carbon-12-atom. Kulstof-12 (C-12) atomet har seks protoner og seks neutroner i sin kerne. I upræcise termer er en AMU gennemsnittet af proton hvilemasse og den neutron hvilemasse.
Anbefalede:
Hvad er den gennemsnitlige atommasse af et atom?

Den gennemsnitlige atommasse af et grundstof er summen af masserne af dets isotoper, hver ganget med dets naturlige overflod (decimalen forbundet med procentdelen af atomer af det element, der er af en given isotop). Gennemsnitlig atommasse = f1M1 + f2M2 +
Hvordan adskiller isotoper sig fra gennemsnitlige atomer af samme grundstof?

Isotoper er atomer med det samme antal protoner, men som har et andet antal neutroner. Da atomnummeret er lig med antallet af protoner, og atommassen er summen af protoner og neutroner, kan vi også sige, at isotoper er grundstoffer med samme atomnummer, men forskellige massetal
Hvordan finder du den gennemsnitlige andel?
Måden at finde en gennemsnitlig proportional er at gange de to tal sammen og derefter finde deres kvadratrod. Det vil være den gennemsnitlige proportional
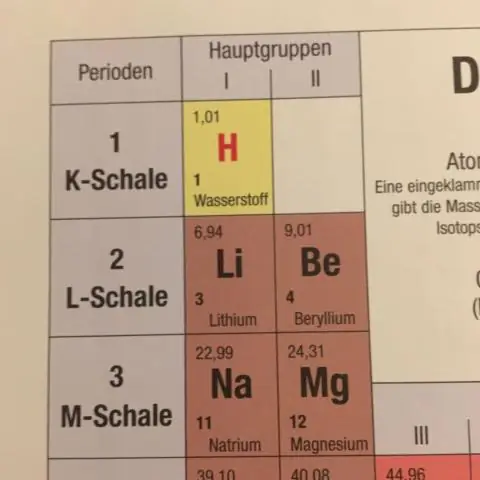
Hvordan bestemmes den gennemsnitlige atommasse vist i det periodiske system?
Den gennemsnitlige atommasse for et grundstof beregnes ved at summere masserne af grundstoffets isotoper, hver ganget med dens naturlige overflod på Jorden. Når du laver masseberegninger, der involverer grundstoffer eller forbindelser, skal du altid bruge den gennemsnitlige atommasse, som kan findes i det periodiske system
Hvordan finder du den gennemsnitlige frie vej?

Den gennemsnitlige frie vej er den afstand, som et molekyle rejser mellem kollisioner. Den gennemsnitlige frie vej bestemmes af kriteriet om, at der er ét molekyle inden i 'kollisionsrøret', der fejes ud af en molekylær bane. Kriteriet er: λ (N/V) π r2 ≈ 1, hvor r er radius af et molekyle
