
Video: Hvordan finder man et grundstofs elektronskal?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Hver skal kan kun indeholde et fast antal elektroner : Den første skal kan rumme op til to elektroner , Sekundet skal kan rumme op til otte (2 + 6) elektroner , den tredje skal kan holde op til 18 (2 + 6 + 10) og så videre. Den generelle formel er, at den n'te skal kan i princippet holde op til 2(n2) elektroner.
Også at vide er, hvad er en skal i elektronkonfiguration?
An elektronskal er den udvendige del af et atom omkring atomkernen. Det er hvor elektron s er og er en gruppe af atomare orbitaler med samme værdi af hovedkvantetallet n.
hvor mange elektroner er der i hver skal? Hver skal kan kun indeholde et fast antal elektroner : Den første skal kan rumme op til to elektroner , Sekundet skal kan rumme op til otte (2 + 6) elektroner , den tredje skal kan holde op til 18 (2 + 6 + 10) og så videre. Den generelle formel er, at den n'te skal kan i princippet holde op til 2(n2) elektroner.
For det andet, hvordan kan du se, hvor mange valenselektroner et grundstof har?
For neutrale atomer er antallet af valenselektroner er lig med atomets hovedgruppenummer. Hovedgruppenummeret for en element kan findes fra dens kolonne i det periodiske system. For eksempel er kulstof i gruppe 4 og har 4 valenselektroner . Ilt er i gruppe 6 og har 6 valenselektroner.
Hvorfor er der kun 8 elektroner i den ydre skal?
De otte- elektroner Et atoms stabilitet stammer fra stabiliteten af ædelgasserne eller det ældre navn inerte gasser, som længe havde været kendt som ureaktive eller ædle. Denne regel er dog berettiget for elementer i anden række i det periodiske system, som deres yderste - skal kapacitet er 8 elektroner.
Anbefalede:
Hvad forårsager et grundstofs emissionsspektrum?

Atomemissionsspektre opstår fra elektroner, der falder fra højere energiniveauer til lavere energiniveauer i atomet, fotoner (lyspakker) med specifikke bølgelængder frigives
Hvordan finder man dimensionerne, når man får areal og omkreds?
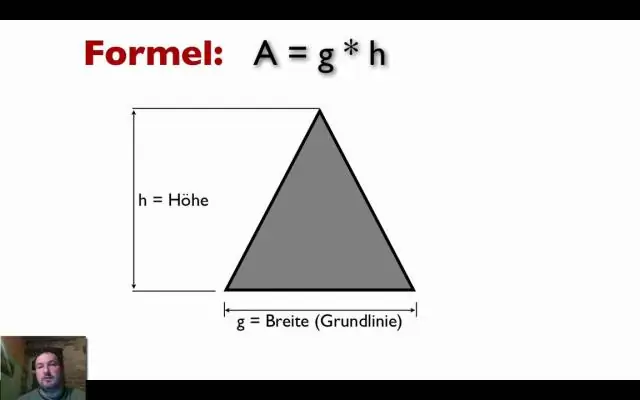
Find længde og bredde, når du kender areal og omkreds Hvis du tilfældigvis kender afstanden omkring rektanglet, som er dets omkreds, kan du løse et par ligninger for L og W. Den første ligning er, at for areal, A = L ⋅ W, og den anden er, at for perimeter, P = 2L + 2W
Hvordan kender man et grundstofs orbitaler?

Bestem antallet af elektroner i atomet af interesse. Antallet af elektroner i atomet er lig med grundstoffets atomnummer. Skriv elektronkonfigurationen for det pågældende grundstof. Udfyld atomets orbitaler i rækkefølgen 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p og 5s
Hvordan finder man højden af en kasse, når man får overfladearealet?
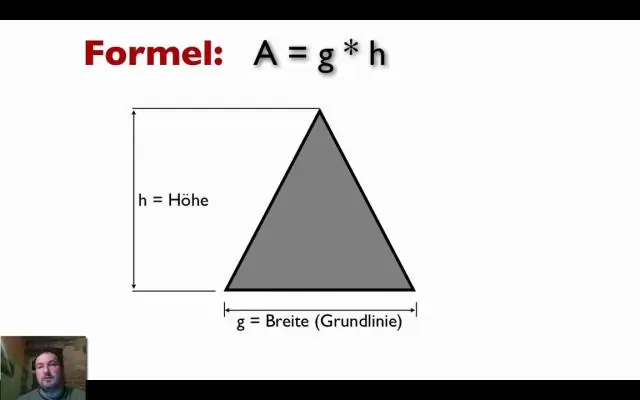
Find ud af ting om en kasse En kasse er oftest kendetegnet ved dens højde og bredde, W og dens længde L. Bredden, højden og længden af en kasse kan alle være forskellige. Rumfanget eller mængden af plads inde i en kasse er h × B × L. Det udvendige overfladeareal af en kasse er 2(h × B) + 2(h × L) + 2(B × L)
Hvordan finder man længden af et rektangel, når man får omkredsen?

Find længde og bredde, når du kender areal og perimeter Hvis du tilfældigvis kender afstanden omkring dit rektangel, som er dets omkreds, kan du løse et par ligninger for L og W. Den første ligning er, at for areal, A = L ⋅ W, og den anden er, at for perimeter, P = 2L+ 2W
