Indholdsfortegnelse:

Video: Hvad er trinene til at løse syrebaseproblemer?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Buffer
- Hvis du kun har en svag syre . Bestem koncentrationen af syre (forudsat at der ikke er nogen dissociation). Slå op eller bestem K-en.
- Hvis du har en svag syre OG konjugatet grundlag . Løse for bufferen.
- Hvis du kun har konjugatet grundlag . Løse for pH af grundlag ved hjælp af Kb og hydrolyseligningen.
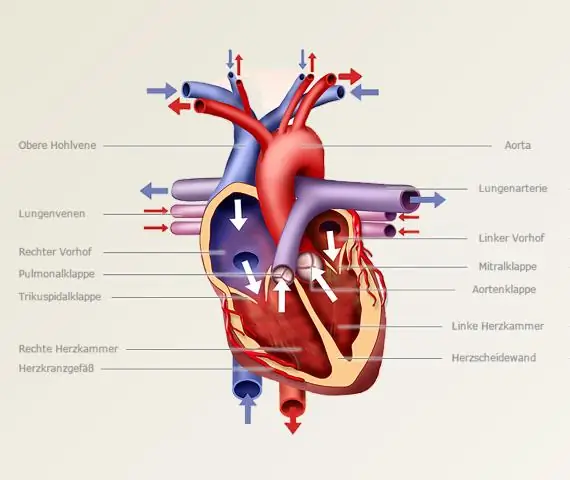
I overensstemmelse hermed, hvordan laver du syrebasetitrering?
Titreringsprocedure
- Skyl buretten med standardopløsningen, pipetten med den ukendte opløsning og den koniske kolbe med destilleret vand.
- Anbring et nøjagtigt målt volumen af analytten i Erlenmeyer-kolben ved hjælp af pipetten sammen med et par dråber indikator.
Ligeledes, hvordan beregner man titrering? Brug titreringsformel . Hvis titranten og analytten har et molforhold på 1:1, formel er molaritet (M) af syren x volumen (V) af syren = molaritet (M) af basen x volumen (V) af basen. ( Molaritet er koncentration af en opløsning udtrykt som antallet af mol opløst stof pr. liter opløsning.)
Desuden, er S F en stærk eller svag base?
Derfor har jeg- er mest stabil og mindst grundlæggende, mens F - er mindst stabil og mest grundlæggende. Stærke baser interagere fuldstændigt med stærk syrer som HCl til at danne et salt og vand i en neutraliseringsreaktion. Andet stærke baser er opløselige oxider, som Na2O og opløselige hydroxidsalte. Stærke baser er stærk elektrolytter.
Hvad bruges titrering til?
EN titrering er en teknik, hvor en opløsning af kendt koncentration er plejede bestemme koncentrationen af en ukendt opløsning. Typisk tilsættes titranten (den kendte opløsning) fra en buret til en kendt mængde af analytten (den ukendte opløsning), indtil reaktionen er fuldstændig.
Anbefalede:
Hvad er trinene til at tegne en funktion?
Trin til skitsering af grafen for funktionen Bestem, om funktionen opnås ved at transformere en enklere funktion, og udfør nødvendige trin for denne enklere funktion. Bestem, om funktionen er lige, ulige eller periodisk. Find y-skæringspunktet (punkt). Find x-skæringspunkter (peger hvor). Find hvilke asymptoter funktion har, hvis nogen
Hvad er trinene til at løse ordproblemer?
Enkle trin til løsning af Word-problemer Læs problemet. Start med at læse problemet omhyggeligt. Identificer og opregn fakta. Find ud af præcis, hvad problemet beder om. Fjern overskydende information. Vær opmærksom på måleenheder. Tegn et diagram. Find eller udvikle en formel. Se en reference
Hvad er trinene til at løse totrins uligheder?

Det tager to trin at løse en ligning eller ulighed, der har mere end én operation: Forenkle ved at bruge det omvendte af addition eller subtraktion. Forenkle yderligere ved at bruge det omvendte af multiplikation eller division
Hvad er trinene til transskription?
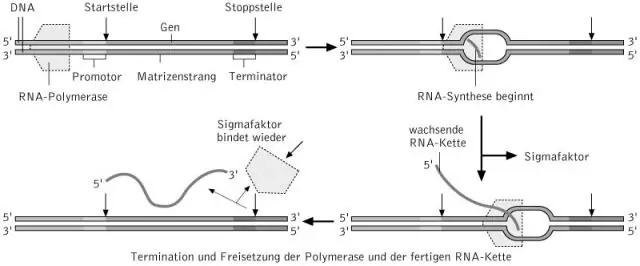
Transskription foregår i tre trin: initiering, forlængelse og afslutning. Trinene er illustreret i figuren nedenfor. Indledning er begyndelsen på transskription. Det opstår, når enzymet RNA-polymerase binder til en region af et gen kaldet promotoren
Hvad er trinene til at løse en ligning?

For at løse en to-trins algebraisk ligning er alt, hvad du skal gøre, at isolere variablen ved at bruge enten addition, subtraktion, multiplikation eller division. Løs en totrinsligning ved at gange i slutningen i stedet for at dividere. x/5 + 7 = -3 = (x/5 + 7) - 7 = -3 - 7 = x/5 = -10. x/5 * 5 = -10 * 5. x = -50
