
Video: Hvordan finder du volumen ved hjælp af Avogadros lov?
2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
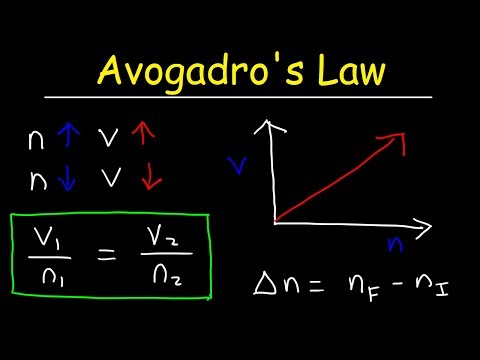
Avogadros lov viser, at der er en direkte sammenhæng mellem antallet af mol af en gas og dens bind . Dette kan også vises ved brug af ligningen: V1/n1 = V2/n2. Hvis antallet af mol fordobles, vil bind vil fordoble.
På denne måde, hvad er formlen for Avogadros lov?
Avogadros lovformel Hvor "V" er volumenet af gassen, "n" er mængden af gassen (antal mol af gassen) og "k" er en konstant for et givet tryk og temperatur. Faktisk, Avogadros lov , hypotesen opstillet af ham, var blandt de love hvorpå den ideelle Gas Lov er baseret.
Derudover, hvad er et eksempel på Avogadros lov? Avogadros lov angiver, at volumenet af en gas er direkte proportional med antallet af mol gas. Her er nogle eksempler . Når du sprænger en basketball i luften, tvinger du flere gasmolekyler ind i den. Jo flere molekyler, jo større volumen. Begge balloner indeholder det samme antal molekyler.
Desuden, hvad siger Avogadros lov, beviser dette laboratorium loven. Hvordan ved du det?
Et moderne statement er : Avogadros lov siger, at "lige volumener af alle gasser, ved samme temperatur og tryk, har det samme antal molekyler." For en given masse af en ideel gas , volumenet og mængden (mol) af gassen er direkte proportional med temperatur og tryk er konstant.
Hvordan forklares loven om at kombinere volumener af Avogadros hypotese?
(en) Loven om at kombinere volumener ved Avogadros hypotese : Alle gasser indeholdende lige mængder ved samme ydre betingelser for temperatur og tryk vil have lige mange molekyler. Disse gasmolekyler reagerer i forholdet mellem små hele tal, så deres (gas) mængder vil også være i forholdet mellem små hele tal.
Anbefalede:
Hvordan finder du imaginære rødder ved hjælp af Descartes tegns regel?

Descartes' tegnregel siger, at antallet af positive rødder er lig med ændringer i fortegn for f(x), eller er mindre end det med et lige tal (så du bliver ved med at trække 2 fra, indtil du får enten 1 eller 0). Derfor kan den foregående f(x) have 2 eller 0 positive rødder. Negative reelle rødder
Hvordan finder du den omtrentlige procentdel ved hjælp af den empiriske regel?

At finde arealet under kurven fra x = 9 til x = 13. Den empiriske regel eller 68-95-99,7 %-reglen giver den omtrentlige procentdel af data, der falder inden for en standardafvigelse (68 %), to standardafvigelser (95 %) og tre standardafvigelser (99,7 %) af gennemsnittet
Hvordan finder man radius af en cirkel ved hjælp af pi?
For at beregne radius af en cirkel ved at bruge omkredsen, tag cirklens omkreds og divider den med 2 gange π. For en cirkel med en omkreds på 15 skal du dividere 15 med 2 gange 3,14 og afrunde decimaltegnet til dit svar på cirka 2,39
Hvordan finder man den modsatte side af en trekant ved hjælp af Pythagoras?
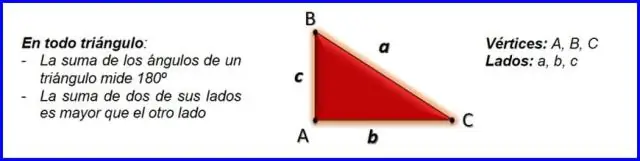
Retvinklede trekanter og Pythagoras sætning Pythagoras sætning, a2+b2=c2, a 2 + b 2 = c 2, kan bruges til at finde længden af enhver side af en retvinklet trekant. Siden modsat den rette vinkel kaldes hypotenusen (side c på figuren)
Hvordan finder man overfladearealet af en pyramide ved hjælp af et net?

VIDEO Med hensyn til dette, hvad er det samlede overfladeareal af en pyramide? Det Overfladeareal af en pyramide Når alle sideflader er ens: [Base Areal ] + 1 / 2 × Omkreds × [Skrålængde] Man kan også spørge, hvordan finder man overfladearealet af en kugle?
