Indholdsfortegnelse:
Video: Hvad er empirisk formel og molekylær formel?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
Molekylære formler fortælle dig, hvor mange atomer af hvert grundstof er i en forbindelse, og empiriske formler fortælle dig det enkleste eller mest reducerede forhold mellem grundstoffer i en forbindelse. Hvis en forbindelse er molekylær formel ikke kan reduceres mere, så empirisk formel er det samme som molekylær formel.
Simpelthen, hvordan finder du den molekylære formel fra den empiriske formel?
Divider molmassen af forbindelsen med empirisk formel masse. Resultatet skal være et helt tal eller meget tæt på et helt tal. Multiplicer alle abonnenter i empirisk formel med det hele tal fundet i trin 2. Resultatet er molekylær formel.
hvad er den empiriske formel for en forbindelse, hvis molekylformel er s6o9? hvis molekylformel er S6O9 at få empirisk formel vi leder efter et tal, der deler det mindste hele talforhold i 6 og 9 til fem (som er definitionen af empirisk formel !).
Simpelthen, hvordan finder du den molekylære formel fra den empiriske formel og molær masse?
Empirisk formel vægt = (1 x 12,01 g/mol) + (2 x 1,01 g/mol) + (1 x 16,00 g/mol) = 30,02 g/mol. Opdel Molar masse for molekylær formel ved empirisk formel masse . Resultatet bestemmer, hvor mange gange der skal ganges abonnenterne i empirisk formel at få molekylær formel.
Hvordan løser du for empirisk formel?
Beregning af en empirisk formel
- Trin 1: Opnå massen af hvert element til stede i gram. Grundstof % = masse i g = m.
- Trin 2: Bestem antallet af mol af hver type atom, der er til stede.
- Trin 3: Divider antallet af mol af hvert grundstof med det mindste antal mol.
- Trin 4: Konverter tal til hele tal.
Anbefalede:
Hvad er molekylær form i kemi?

Molekylær geometri er det tredimensionelle arrangement af de atomer, der udgør et molekyle. Det inkluderer den generelle form af molekylet samt bindingslængder, bindingsvinkler, vridningsvinkler og andre geometriske parametre, der bestemmer hvert atoms position
Hvad er molekylær test for kræft?

I medicin, en laboratorietest, der kontrollerer for bestemte gener, proteiner eller andre molekyler i en prøve af væv, blod eller anden kropsvæske. Molekylære tests kontrollerer også for visse ændringer i et gen eller kromosom, der kan forårsage eller påvirke chancen for at udvikle en specifik sygdom eller lidelse, såsom kræft
Hvordan skriver man en empirisk formel med procenter?

Transskription Divider hver % med grundstoffets atommasse. Divider hvert af DISSE svar med det mindste. Juster disse tal til deres laveste hele talforhold
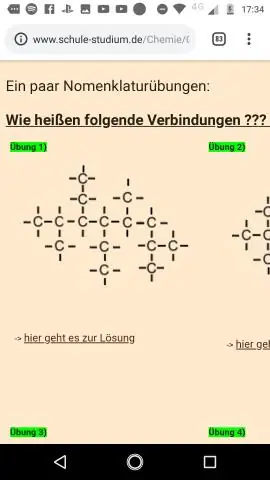
Hvad er en strukturel formel Hvad er forskellen mellem en strukturel formel og en molekylær model?
En molekylær formel bruger kemiske symboler og underskrifter til at angive det nøjagtige antal af forskellige atomer i et molekyle eller en forbindelse. En empirisk formel giver det enkleste hele talforhold mellem atomer i en forbindelse. En strukturel formel angiver bindingsarrangementet af atomerne i molekylet
Hvad betyder empirisk regel?

Definition af den empiriske regel Den empiriske regel siger, at for en normalfordeling vil næsten alle data falde inden for tre standardafvigelser af middelværdien. Den empiriske regel kan opdeles i tre dele: 68 % af data falder inden for den første standardafvigelse fra middelværdien
