
Video: Hvorfor er der fald i ioniseringsenergi?

2024 Forfatter: Miles Stephen | [email protected]. Sidst ændret: 2023-12-15 23:34
På grund af den ekstra orbital øges atomradierne, og elektronerne er længere væk fra kernen. Så det kræver mindre energi at adskille en elektron fra dens kerne. Den ekstra orbital har sin elektrontæthed længere væk fra kernen, og derfor det lille fald i ioniseringsenergi.
I betragtning af dette, hvorfor er der uoverensstemmelser i ioniseringsenergi?
Det uoverensstemmelser kan forklares med enten elektronafskærmning eller ved elektronelektronafstødning. Tendensen til atomradius er at falde over en periode og at øge en familie. Efterhånden som vi bevæger os hen over perioden, stiger kerneladningen og trækker elektronerne stærkere ind.
Efterfølgende er spørgsmålet, hvorfor er ioniseringsenergien af S lavere end P? Siden den 3 s elektroner i svovl (at svovl ville tabe) er parret, svovl har mere elektronafstødning i disse orbitaler end fosfor gør, så det tager mindre energi input at fjerne en elektron fra svovl . Derfor, da ionisering opstår lettere, den ioniseringsenergi er mindre.
Ligeledes, hvorfor er der et fald i ioniseringsenergi fra Mg til Al?
Det først er mellem Mg og Al , fordi det ydre elektron af Mg er i det orbital 3s, hvorimod den af Al er i 3p. Det 3p elektron har mere energi end det 3s elektron, altså ioniseringsenergien af Al er faktisk mindre end Mg.
Hvordan bestemmer man elektronegativitet?
At beregne elektronegativitet , start med at gå online til Find en elektronegativitet bord. Du kan derefter vurdere kvaliteten af en binding mellem 2 atomer ved at slå op på deres elektronegativiteter på bordet og trække den mindre fra den større. Hvis forskellen er mindre end 0,5, er bindingen ikke-polær kovalent.
Anbefalede:
Hvordan beregner man potentielt fald i et kredsløb?
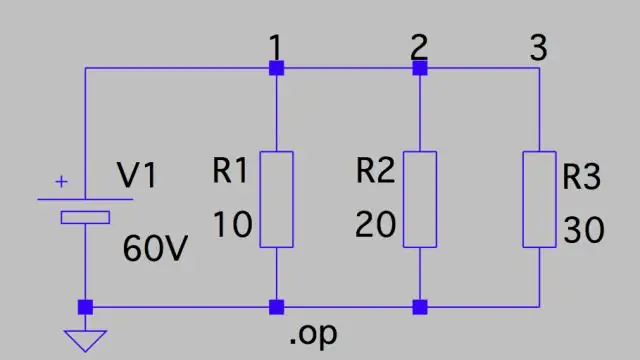
Spændingsfald: Parallel kredsløb Dette betyder, at spændingsfaldet over hver af dem kun er kredsløbets samlede spænding divideret med antallet af modstande i kredsløbet, eller 24 V/3 = 8 V
Hvordan finder du intervaller for stigning og fald?

Den afledte af en funktion kan bruges til at bestemme, om funktionen er stigende eller faldende på et hvilket som helst intervaller i dens domæne. Hvis f'(x) > 0 i hvert punkt i et interval I, så siges funktionen at være stigende på I. f'(x) < 0 i hvert punkt i et interval I, så siges funktionen at være aftagende på I
Hvorfor er den anden ioniseringsenergi af lithium så usædvanligt større end den første?

Anden ioniseringsenergi er altid højere end den første på grund af to hovedårsager: Du fjerner elektronen fra en position, hvor den er lidt tættere på kernen og derfor er genstand for større tiltrækning til kernen
Hvordan påvirker overfladearealet fald?

Når luftmodstanden virker, vil accelerationen under et fald være mindre end g, fordi luftmodstanden påvirker bevægelsen af de faldende genstande ved at bremse den. Luftmodstand afhænger af to vigtige faktorer - objektets hastighed og dets overfladeareal. Forøgelse af overfladearealet af et objekt mindsker dets hastighed
Hvordan finder du det første fald i frit fald?

VIDEO Udover dette, hvordan finder du tid i frit fald? Frit fald / faldende hastighedsligninger Tyngdekraften, g = 9,8 m/s 2 Tyngdekraften accelererer dig med 9,8 meter i sekundet i sekundet. Tid til at sprøjte: sqrt (2 * højde / 9,8) Hastighed ved splat-tid:
